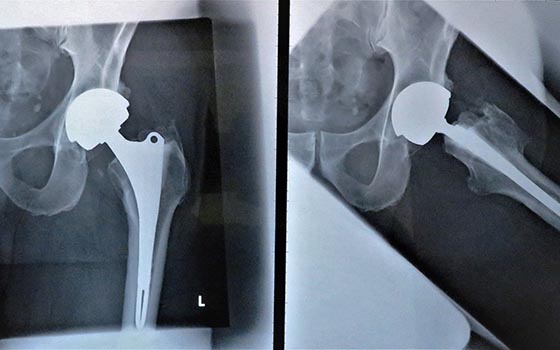
Die Selbsthilfegruppe Durom-Metasul-LDH-Hüftprothesen e.V. (Durom-SHG) wurde 2010 gegründet. Anlass waren hunderte von Patienten, die im Loretto Krankenhaus in Freiburg eine fehlerhafte Durom-Metasul-LDH-Hüftprothese implantiert bekommen hatten. Viele leiden seither unter gesundheitlichen Einschränkungen. Obwohl das BfArM (Bundesinstitut für Arzneimittel und Medizinprodukte) empfohlen hatte, das Durom-Prothesenmodell vom Markt zu nehmen, weigerte sich das zuständige Regierungspräsidium in Freiburg, der Empfehlung zu folgen.
Die Durom-SHG hat sich zum Ansprechpartner für viele unterschiedliche Problemprothesen entwickelt. Sie recherchiert Hintergründe, steht im Austausch mit Fachleuten und bereitet auf der Homepage Informationen zum Thema „fehlerhafte Medizinprodukte“ auf. Betroffene können sich bei Fragen und Problemen an die Durom-SHG wenden. Wir vermitteln Kontakte und bemühen und, Antworten zu finden. Im Bereich „Kommentare“ können Betroffene Fragen stellen und Erfahrungen austauschen.
Neueste Beiträge
Hüft-Operationen pro Jahr
in Deutschland.
pro Jahr für das Gesundheitssystem.
Kosten: Platz 2 in Europa
Qualität: Platz 20 in Europa
Minuten Arbeitsaufwand des
Vorstands seit
der Gründung 2010.